Aktuelle Studien
Derzeit steht die Welt im Angesicht des Klimawandels vor der großen Herausfoderung eine ausreichende und gesunde Ernährung zu gewährleisten. Dabei müssen Umweltaspekte berücksichtig werden welche die lokale Produktionsgrenzen aber auch globale Lieferketten im Auge behalten. Da absehbar ist, dass sich Vegetationsbereiche für die Lebensmittelproduktion durch Landverbrauch und Klimawandel zunehmend verkleinern werden ist ein nachhaltiges Bewirtschaften des Bodens und der aquatischen Bereiche notwendig. Die Qulität der Lebensmittel ist ein weiterer Bereich der unter anderem im Sinne des Tierwohls und der Produktivität diskutiert werden muss.
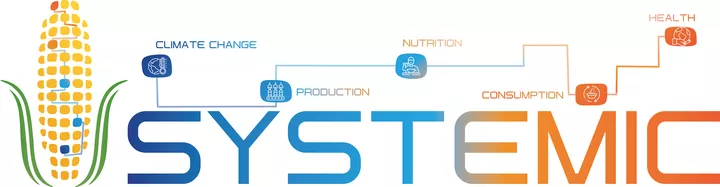
Für alle diese Fragen hat sich im Juli 2020 ein transnationales Konsortium unterschiedlicher Forschungseinrichtungen aus acht europäischen Ländern (Ita, Nor, Por, Esp, Fra, Deu, Bel und Let) gebildet, das mit jeweils nationalen Forschungsgeldern den partnerschaftlichen Austausch fördert und Wissenslücken bezüglich der oben skizzierten Problematiken schließen möchte. Der Verbund der europäischen Joint-Programming-Initiative (JPI) ist mit dem Namen SYSTEMIC angetreten einen „integrierten Ansatz für die Herausforderung nachhaltiger Lebensmittel“ zu bearbeiten. Das ZIEL Institute for Food and Health der Technischen Universistät München trägt mit seiner Expertise in gesunder Ernährung und der Durchführung von humanen Interventionsstudien zur Wissensgenerierung zu zwei von sieben Arbeitspaketen bei. Weitere Informationen und Kooperationsmöglichkeiten können über den Link http://systemic-hub.eu/ abgerufen werden.
Viele der heute weit verbreiteten sogenannten Zivilisationskrankheiten haben einen gemeinsamen Risikofaktor: Übergewicht und Adipositas. Die daraus entstehenden Stoffwechselerkrankungen wie beispielsweise Diabetes mellitus, Bluthochdruck und Arteriosklerose belasten die Betroffenen sehr und schränken die alltägliche Aktivität ein.
Hunger und Sättigung sind wichtige Faktoren, welche die Entstehung von Übergewicht bestimmen. Bekannt ist, dass Kohlenhydrate, Fette und Proteine unterschiedlich auf die Sättigung wirken. Die hormonellen Mechanismen dahinter sind jedoch bislang nur unzureichend verstanden. Zudem erregt ein wiederentdeckter Gewebetyp zunehmend Interesse. Das sogenannte braune Fettgewebe (BAT) ist in der Lage Energie in Form von Wärme freizusetzen und bietet so eine Möglichkeit mittels einer erhöhten Wärmeproduktion der Entwicklung von Übergewicht entgegenzuwirken. Das von der Deutschen Forschungsgemeinschaft (DFG) geförderte Projekt widmet sich nun der Frage, ob und wie sich dieses Fettgewebe durch eine definierte Ernährungsintervention aktivieren lässt.
Dazu bildet die Zusammenarbeit verschiedener Institute der Technischen Universität München (TUM) die iMAGO (Non-invasive imaging of tissue plasticity and adaptation in response to metabolic challenges) Forschungsgruppe, die neue nicht-invasive Methoden entwickelt bzw. erweitert um Stoffwechselprozesse darzustellen und Menschen mit Adipositas besser diagnostizieren und behandeln zu können.
Im Studienzentrum des ZIEL - Institute for Food and Health an der TUM wird hierfür die mahlzeitenabhängige Reaktion der Sekretinausschüttung und die Aktivität des braunen Fettgewebes untersucht.
Wir suchen gesunde Menschen (Kaukasier, Frauen und Männer)
- Alter: ab 18 Jahre
- BMI > 27 kg/m2
Wenn Sie teilnehmen möchten, wenden Sie sich bitte für weitere Informationen an Herrn Tianxing Du (tianxing.du@tum.de).
Die Studie „XcellentDiet“ untersucht die Genauigkeit der gleichnamigen App bei der Erfassung von Kalorien- und Nährstoffangaben im Vergleich zu Referenzwerten. Die App nutzt Bilderkennung, Text- und Spracherfassung, um die Dokumentation der Ernährung zu vereinfachen. 30 Probanden dokumentieren über vier Tage ihre Mahlzeiten durch Wiegeprotokolle und Fotos aus zwei Perspektiven. Diese Daten werden mit der Ernährungssoftware „OptiDiet®“ sowie vergleichbaren ernährungsbezogenen Apps (z.B.: Cal AI) analysiert, um die Genauigkeit mit vorhandenen Methoden zu untersuchen. Zusätzlich wird die Konsistenz der Bilderkennung bei verschiedenen Kameramodellen, Aufnahmewinkeln und wiederholten Analysen geprüft. Die Sprachfunktion wird durch das Einspeichern von Ernährungsprotokollen getestet. Ziel ist es, die Zuverlässigkeit und Effizienz von „XcellentDiet“ als innovatives Tool zur Ernährungsdokumentation zu bestätigen.
Weiter Informationen finden Sie auf der DRKS Webseite oder in unserem Flyer.
Wir sind auf der Suche nach zusätzlichen Software/KI Ingenieur(inn)en!

Abgeschlossene Studien
Allulose als Zuckerersatz nicht nur bei Diabetes
Allulose ist ein natürlich vorkommender Zucker, der eine etwas geringere Süßkraft als Haushaltszucker hat, und sich im Geschmack kaum unterscheidet. Aufgrund seiner Eigenschaften kann Allulose in energiereduzierten Lebensmitteln und Getränken als Zuckerersatz Anwendung finden.
Aus ersten Studien ist bereits bekannt, dass Allulose nur in sehr geringen Mengen verstoffwechselt, und über die Nieren nahezu unverändert ausgeschieden wird. Daraus resultiert, dass Allulose kaum Energie liefert, und der Verzehr keinen Anstieg des Blutzuckerspiegels zur Folge hat. Für Diabetiker bring dies den Vorteil, dass der Körper kein Insulin benötigt, um die Allulose zu verarbeiten. Bei Gewichtsproblemen kann der Verzehr Allulose-gesüßter Lebensmittel einen positiven Einfluss auf das Körpergewicht haben.
Da für Allulose, die in den USA und in Asien einen Unbedenklichkeitsstatus (GRAS = generally recognised as safe) erhalten hat, die EU-Zulassung beantragt wurde, sind weitere Studien notwendig auf deren Grundlage diese Zulassung erfolgen soll. Die Core Facility für Humanstudien des ZIEL - Institute for Food and Health an der TUM untersucht im Rahmen einer solchen Zulassungsstudie die dosisabhängige Aufnahme, Metabolisierung und Ausscheidung der Allulose. Gleichermaßen ist die Bewertung der Verträglichkeit und aus Auftreten möglicher Nebenwirkungen, wie Magen-Darm-Beschwerden, von Interesse.

Übergewicht und Adipositas führen zu metabolischen Erkrankungen, wie z.B. Diabetes mellitus Typ 2 oder Dyslipidämien und in der Folge vermehrt zu KHK oder Schlaganfällen. Leitlinien empfehlen zur Prävention von Folgeschäden die Reduktion des Körpergewichtes.
Unter den verschiedenen Strategien stellt das 16/8 Intervallfasten eine nicht restriktive Methode dar, welche die gesamte Aufnahme der täglichen Kalorien während einer 8-stündigen Periode erlaubt und gleichzeitig nachweislich mit einer moderaten Körpergewichtsreduktion einhergeht. Die Fastenzeit von 16 Stunden birgt jedoch die Gefahr, dass ein starkes Hungergefühl dem möglichen Erfolg des Intervallfastens entgegenwirkt. Um dieses jedoch zu verhindern, könnte die erhöhte Aufnahme von zusätzlichen Ballaststoffen eine Lösungsstrategie darstellen, da Ballaststoffe nachweislich die Sättigung fördern.
Im Rahmen des DFG-Antrages von Dr. Beate Brandl wollen wir den Effekt von Ballaststoffen auf die Sättigung in einem 16/8 intermittierenden Fastenversuch in einer Studie untersuchen. Über 12 Wochen wird dabei unter Alltagsbedingungen die Ballaststoffmenge um 40 g/Tag erhöht. Mit Hilfe der Daten hoffen wir, die Frage klären zu können, ob Ballaststoff-angereicherte Lebensmittel ein länger anhaltendes Sättigungsgefühl beim 16/8 intermittierende Fasten unterstützen, sodass Gewicht leichter reduziert und somit das KHK-Risiko sowie das Risiko an Diabetes mellitus Typ 2 zu erkranken, gesenkt werden kann.
Mikronährstoffe sind Spurenelemente und Vitamine, die vom Menschen im Wesentlichen aus der Nahrung aufgenommen werden und essentiell für viele physiologische Funktionen sind. Dennoch sind etwa zwei Milliarden Menschen weltweit – auch hierzulande - von einem Mikronährstoffmangel betroffen. Die Ursachen einer Mangelversorgung sind vielfältig und reichen von regionalen Bodenverhältnissen bis hin zu Unter- oder Mangelernährung oder einer unausgewogenen Ernährungsweise.
Eine wichtige Eigenschaft von Mikronährstoffen, wie Selen, Vitamin D oder Zink ist deren Rolle im Immunsystem, vor allem in der Immunabwehr. In vielen Studien wurden bereits Zusammenhänge zwischen einem Mangel dieser Nährstoffe und dem erhöhten Risiko für bakterielle und virale Infektionskrankheiten, möglicherweise auch für eine SARS-CoV-2-Infektion festgestellt.
Als Teil der EIT (European Institute of Technology) Crisis Response Initiative wurde deshalb die MeDiCo-Health (Micro-nutrient Deficiency in Covid-19 patients and Health care professionals) Studie ins Leben gerufen als Reaktion auf die aktuelle COVID-19 Pandemie. Im Rahmen der MeDiCo-Health Studie wurde unter anderem untersucht, ob der Mikronährstoffstatus und das Essverhalten von Personen, die mit SARS-CoV-2 infiziert sind, Auswirkungen auf den Verlauf der Krankheit haben.

In der Ernährungsforschung ist die Qualität der Ernährungserhebung von großer Bedeutung, um Zusammenhänge zwischen Ernährung bzw. Nährstoffen und Gesundheit in größeren Kohorten untersuchen zu können. Die zuverlässige Erfassung der Zufuhr von Lebensmitteln, Nährstoffen oder auch Lebensmittelkontaminanten ist eine große Herausforderung, denn Ungenauigkeiten der derzeit zur Verfügung stehenden Erhebungsmethoden (Fragebögen) liefern oft verzerrte bzw. irreführende Ergebnisse [1,2]. Biomarker für den Verzehr verschiedener Lebensmittel, Lebensmittelgruppen oder ‑inhaltsstoffen können ein objektives Maß für die Zufuhr und als Ergänzung zu den klassischen Methoden der Ernährungsforschung sein [3,4]. Jedoch gibt es bis heute für nur wenige Lebensmittel validierte „food-biomarker“. Zwar existieren in der Medizin etablierte Konzepte für die Identifizierung von Krankheits-Biomarkern, aber zur Entwicklung von Biomarkern des Ernährungsstatus fehlen nach wie vor klare Empfehlungen. Viele Marker wurden vorgeschlagen, aber nur wenige sind ausreichend validiert und gelten als repräsentativ für die Aufnahme eines Lebensmittels und/oder zur Bestimmung des Ernährungsstatus [5,6].
Ziel dieser Studie war es daher mögliche Biomarker für ausgewählte Lebensmittel (Rindfleisch, Hähnchenfleisch) zu identifizieren. Dazu sammelten wir zu definierten Zeitpunkten vor und nach einer Testmahlzeit Blut- und Urinproben und analysierten ein möglichst breites Spektrum an Metaboliten in Blut und Urin. Durch die wiederholten Probennahmen über den Zeitraum von bis zu 48 Stunden bestimmten wir die Biokinetik der Lebensmittelinhaltsstoffe oder deren Metabolite. Mit Hilfe von bioinformatischen und biostatistischen Methoden konnten wir ein kleines Spektrum von Faktoren bestimmen, die auf einen Fleischkonsum hinweisen (z.B. 𝝅-Methylhistidin, Trimethylamin-N-Oxide (TMAO), Dimethylglycin). Allerdings bleiben derzeit Fragen nach der Spezifität der Marker noch unbeantwortet.
Die Ergebnisse wurden nun im Rahmen einer Publikation in der Fachzeitschrift „Molecular Nutrition & Food Research“ veröffentlicht und diskutiert:
Giesbertz P. & Brandl B. et al. Specificity, Dose Dependency, and Kinetics of Markers of Chicken and Beef Intake Using Targeted Quantitative LC-MS/MS: a Human Intervention Trial. Mol Nutr Food Res. 2020 Jan 9:e1900921: https://onlinelibrary.wiley.com/doi/10.1002/mnfr.201900921
Literatur
[1] Jenab M, Slimani N, Bictash M, Ferrari P, Bingham SA. Biomarkers in nutritional epidemiology: applications, needs and new horizons. Human genetics 2009; 125(5‐6): 507‐25.
[2] Penn L, Boeing H, Boushey CJ, et al. Assessment of dietary intake: NuGO symposium report. Genes & nutrition 2010; 5(3): 205‐13.
[3] Scalbert A, Brennan L, Manach C, et al. The food metabolome: a window over dietary exposure. The American journal of clinical nutrition 2014; 99(6): 1286‐308.
[4] Garcia‐Aloy M, Llorach R, Urpi‐Sarda M, et al. Novel multi‐metabolite prediction of walnut consumption by a urinary biomarker model in a free‐living population. Journal of proteome research 2014.
[5] Hjerpsted J, Ritz C, Schou S, Tholstrup T, Dragsted L. Effect of cheese and butter intake on metabolites in urine using an untargeted metabolomics approach. Metabolomics 2014: 1‐10.
[6] Stanstrup J, Schou SS, Holmer‐Jensen J, Hermansen K, Dragsted LO. Whey Protein Delays Gastric Emptying and Suppresses Plasma Fatty Acids and Their Metabolites Compared to Casein, Gluten, and Fish Protein. Journal of proteome research 2014.
Trimethylamin-N-Oxid (TMAO) ist ein Biomarker für die Aufnahme von Fisch, Fleisch und Eiern [1, 2]. Mehrere Studien deuten auf einen Zusammenhang zwischen erhöhten TMAO-Plasmaspiegeln und einem zunehmenden Risiko für Herz-Kreislauf-Erkrankungen hin [3, 4]. In der meatmark Studie wurde dieser Biomarker genauer untersucht.
Neben dem natürlichen Vorkommen von TMAO in Lebensmitteln z.B. in Fischen, kann TMAO im Körper selbst hergestellt werden. Zunächst produzieren Mikroorgansimen im Darm TMA (Trimathylamin) aus den Verbindungen Cholin, Betain und L-Carnitin, welche mit der Nahrung aufgenommen werden. TMA wird anschließend in der Leber zu TMAO umgewandelt. Der TMAO Wert im Plasma ist somit sowohl von der Ernährung, als auch von der Zusammensetzung und Aktivität der Darmbakterien abhängig [3,4].
Ziel der meatmark Studie war es einerseits zu untersuchen ob mittels einer gezielten Ballaststoff-supplementierung das Darmmikrobiom so moduliert werden kann, dass es Auswirkungen auf die Produktion von TMA/TMAO nach dem Verzehr von Rindfleisch hat. Andererseits wurden zwei Gene des TMAO-Metabolismus auf Mutationen und deren Auswirkung auf die Plasma TMAO Spiegel untersucht.
Für die Studie wurden 14 gesunde Probanden (7 Frauen, 7 Männer) im Alter von 18 bis 40 Jahren rekrutiert, die in einer randomisierten cross-over Doppelblind-Studie 200 g Rindfleisch in Form einer Testmahlzeit verzehrten. Vor dieser Rindfleischintervention fand eine zweiwöchige, verblindete Ballaststoffsupplementierung (mit einem Ballaststoff- oder Placebopräparat) statt. Zu definierten Zeitpunkten vor und nach der Intervention wurden Blut, Urin,- und Stuhlproben gesammelt und mit verschiedenen Methoden analysiert.
Literatur
[1] E. M. Brouwer-Brolsma, L. Brennan, C. A. Drevon, H. van Kranen, C. Manach, L. O. Dragsted, H. M. Roche, C. Andres-Lacueva, S. J. L. Bakker, J. Bouwman et al., The Proceedings of the Nutrition Society, DOI: 10.1017/S0029665117003949 .
[2] A. Scalbert, L. Brennan, C. Manach, C. Andres-Lacueva, L. O. Dragsted, J. Draper, S. M. Rappaport, J. J. J. van der Hooft, D. S. Wishart, The American journal of clinical nutrition, DOI: 10.3945/ajcn.113.076133 .
[3] Ulaszewska MM, Weinert CH, Trimigno A, Portmann R, Lacueva CA, Badertscher R, Brennan L, Brunius C, Bub A, Capozzi F, Rosso MC, Cordero CE, Daniel H, Durand S, Egert B, Ferrario PG, Feskens EJM, Franceschi P, Garcia-Aloy M, Giacomoni F, Giesbertz P, Domínguez RG, Hanhineva K, Hemeryck LY, Kopka J, Kulling S, Llorach R, Manach C, Mattivi F, Migné C, Münger LH, Ott B, Picone G, Pimentel G, Pujos-Guillot E, Riccadonna S, Rist M, Rombouts C, Rubert J, Skurk T, Sri Harsha PSC, van Meulebroek L, Vanhaecke L, Vázquez-Fresno R, Wishard D, and Vergères G. Nutrimetabolomics: An Integrative Action for Metabolomic Analyses in Human Nutritional Studies. Mol Nutr Food Res 2018:e1800384. Doi: http://dx.doi.org/10.1002/mnfr.201800384<
Eine ballaststoffreiche Ernährung hat einen positiven Effekt auf die Sättigung, reguliert die Verdauung, fördert die Darmgesundheit [1] und verringert das Risiko für zahlreiche ernährungsmitbedingte Erkrankungen wie z.B. Diabetes mellitus Typ 2 und Arteriosklerose, die zu Herzinfarkt und Schlaganfall führen kann [2, 3, 4]. Einige positive Effekte, unter anderem auf die Darmgesundheit, lassen sich auf die Erhöhung der Stuhlmenge [5, 6, 7] und die verringerte Transitzeit zurückführen [5 ,8 ,9]. Bei einer ausreichenden Flüssigkeitszufuhr vermindert die kürzere Transitzeit, eine harte Stuhlkonsistenz und damit die Gefahr einer Divertikulose [10], die zu häufigen Entzündungen und zum Darmdurchbruch führen kann. Zudem weisen einige Studien darauf hin, dass Ballaststoffe auch Gallensäuren binden, was im Dünndarm deren Rücktransport ins Blut verhindert und die Gallensäuresynthese steigert. Aufgrund dessen schreiben einige Autoren den Ballaststoffen eine cholesterinsenkende Wirkung zu [11. 12, 13, 14]. Die Erhöhung der Stuhlmenge durch das Beimengen von Ballaststoffen in Form von Zuckerrübenfasern, Gerstenfasern und Haferkörnerfasern in der Ernährung konnte bereits gezeigt werden und wurde mit einem Health Claim versehen [14, 6]. Somit sind gesundheitsbezogene Aussagen in der Werbung möglich.
In der vorliegenden Studie wurde der Fokus auf die Weizenfaser bezüglich ihrer Erhöhung der Stuhlmenge gesetzt. Um den Effekt der Weizenfaser auf das Stuhlvolumen zu untersuchen, bekamen die Probanden gemäß einem cross-over-Design in einer zufälligen Reihenfolge verblindet entweder mit Weizenfasern angereichte Lebensmittel, ein mit Weizenfaser angereichertes Getränk oder das jeweilige Placebo ohne Ballaststoffe. In Kooperation mit einem Industriepartner, entwickelten wir mit Weizenfasern angereicherte Lebensmittel und ein Weizenfaser-angereichertes Getränk. Die Probanden erhielten somit in der aktiven Ballaststoffintervention pro Tag 10 g unlösliche Ballaststoffe in Form einer Weizenfaser zusätzlich zu Ihrer üblichen Ernährung. Um die Ballaststoffzufuhr alltagsnah und physiologisch zu gestalten, wurden die insgesamt 10 g Weizenfaser/Tag (3x 3,33 g Weizenfaser/Portion) als Getränke bzw. Lebensmittel angeboten. Während der Placebo-Phasen bekamen die Probanden die gleichen Produkte ohne die Ballaststoffe.
Zu definierten Zeitpunkten wurde vor, während und nach der Intervention die Stuhlmenge sowohl frisch als auch im gefriergetrockneten Zustand erfasst. Um ein möglichst breites Spektrum der Wirkung der erhöhten Aufnahme von Weizenfaser auf die Physiologie des Menschen zu analysieren, wurden neben den Stuhlproben auch Urinproben gesammelt.
Die detaillierten Ergebnisse wurden im Rahmen einer Publikation in der Fachzeitschrift „Nutrients“ veröffentlicht:
Brandl et al. Effects of Extrinsic Wheat Fiber Supplementation on Fecal Weight; A Randomized Controlled Trial. Nutriens. 2020, 12, 298.
Literatur
[1] Cummings JH. The effect of dietary fiber on faecal weight and composition. Spiller GA, ed. CRC handbook of dietary fiber in human nutrition, 2nd edn. Boca Raton: CRC Press, 1993; 263–349.
[2] Trowell H. Ischemic heart disease and dietary fiber. American Journal of Clinical Nutrition 1972; 25: 926–932.
[3] Southgate DAT. Dietary fibre and the diseases of affluence. In a Balanced Diet 1988; 117–139.
[4] Chen K, Qiu JL, Zhang Y, Zhao YW. Metaanalysis of risk factors for colorectal cancer. World J Gastroenterol. 2003 Jul 15; 9(7): 1598–1600.
[5] Drasar BS, Jenkins DJA, Cummings JH. The influence of a diet rich in wheat fibre on the human faecal flora. Journal of Medical Microbiology 1976; Vol 9.
[6] Chen HL, Haack VS, Janecks CW, Vollendorf NW, Marlett JA. Mechanisms by which wheat bran and oat bran increase stool weight in humans. American Journal of Clinical Nutrition 1998; 68:711-9.
[7] Stephen AM, Wiggins HS, Englyst HN, Cole TJ, Wayman BJ, Cummings JH. The effect of age, sex and level of intake of dietary fibre from wheat on large-bowel function in thirty healthy subjects. British Journal of Nutrition 1986; 56: 349-361.
[8] Monro JA. Wheat bran equavilents based on faecal bulking indices for dietary management of faecal bulk. Asia Pacific Journal Clinical Nutrition 2001; 10 (3): 242-248.
[9] Lairon D, Arnault N, Betrais S, Planells R, Clero E, Herchberg S, Boutron-Ruault MC. Dietary fibrer intake and risk factors for cardiovascular disease in French adults. American Journal of Clinical Nutrition 2005;82:1185-94.
[10] Aldoori WH: The protective role of dietary fiber in diverticular disease. Adv Exp Med Biology 1997; 427; 291–308.
[11] Brown L, Rosner B, Willet WW, Sacks FM. Cholesterol-lowering effects of dietary fiber - A meta-analysis. American Journal of Clinical Nutrition 1999; 69: 30.
[12] Truswell AS, Beynen, AC. Dietary fibre and plasma lipids: Potential for prevention and treatment of hyperlipidemias. Dietary Fibre - a Component of Food 1992; 295-332.
[13] Truswell AS. Meta-analysis of the cholesterol-lowering effects of dietary fibre. American Journal of Clinical Nutrition. 1999; 70(5):942-3.
[14] Langkilde AM, Andersson H, Bosaus I. Sugar-beet fibre increase cholesterol and reduces bile acid excretion from the small bowel. British Journal of Nutrition 1993; 70: 757-766.
